חומרי חיטוי על בסיס כלור לטיפול במים
חומרי חיטוי על בסיס כלור לטיפול במים
השימוש בתרכובות כלור בטיפול במים נועדו למנוע התפשטות של מחלות המועברות ע"י המים כמו – טיפוס, דיזנטריה וכולרה. הכלור נחשב לחומר חיטוי יעיל המוכנס למי שתייה כדי לקטול מיקרואורגניזם כמו – חיידקים, וירוסים , פטריות אצות וכו' . מיקרואורגניזמים אילו "מתיישבים" ומתרבים בציוד הבא במגע עם מים כגון – צנרת, משאבות , ברזים ,מכלי אחסון , בריכות שחייה וכד'.
ב-1810 גילה המדען הבריטי האמפרי דייווי, שהכלור הוא יסוד, לאחר שניסה להפריד אותו (תוך מחשבה שהכלור הוא תרכובת) ונכשל. הוא העניק ליסוד שנתגלה את השם "כלור", שם שמקורו במילה היוונית "כלורוס" שפירושה "צהוב-ירקרק".
כאן המקום לנסות ולהסביר את ההבדל בין כלור לכלוריד דבר שגורם לרבים וטובים להתבלבל:
כלור הוא יסוד כימי שסמלו הכימי Cl. מולקולת הכלור היא מולקולה דו אטומית המסומלת כ-Cl2. שני אטומי הכלור שבמולקולה קשורים ביניהם בקשר קוולנטי יחיד (Cl-Cl). הכלור הוא גז צהוב-ירקרק, רעיל ובעל ריח צורב. במערכה המחזורית הוא יהיה בטור ההלוגנים . מייצרים כלור בתהליך אלקטרוליזה של מלח בישול (נתרן כלורי) .
כלוריד הוא אניון (יון שלילי) של היסוד כלור, הנוצר כאשר אטום כלור מקבל אלקטרון עודף אחד, ליצירת −Cl. כלורידים יכולים להיות חלק מתרכובות אורגניות או אי-אורגניות.
תהליך הוספת הכלור במים נקרא הכלרה .בגלל יעילותו השימוש בכלור נפוץ ברחבי העולם. מנגנון החיטוי עם גז כלור מבוסס על התגובה:
Cl2 + H2O → HOCl + HCl
חומצה חומצה מים כלור מלחית היפוכלוריט
החומצה היפוכלוריט יעילה והיא גורם החיטוי כנגד המיקרואורגניזמים. בתגובה נוצרת חומצה מלחית התורמת להורדה ב- -PH .
חסרונות השימוש בגז כלור:
- הוא עלול להגיב עם תרכובות אורגניות הנמצאות במים ליצירת תרכובות הנקראות DBPS (Disinfection By-products). הם נוצרים במהלך שלב החיטוי של טיפול במים ,כאשר חומרי חיטוי מגיבים עם חומר אורגני מומס (DOM) וכמה תרכובות אנאורגניות הנמצאות במים. טריכלורומתאן, או כלורופורם, ה-DBP הראשון שזוהה ב-1974 .
יחד עם שלושת הטריהלומתנים הנפוצים ביותר (THMs) : טרי ברומו מתאן (ברומופורם), ברומו די כלורו מתאן ודי ברומו כלורו מתאן. חומרים אילו הם חומרים הנחשבים קרצינוגניים.
- הוא לא יעיל כנגד סוגים מסוימים של טפילים חד-תאיים, כגון אמבות, טריכומונדות וקוקסידיות, הם בעלי מבנה פשוט, ולכן הם פחות רגישים לכלור.
- קורוזיבי למתכות מסוימות כגון פלדה אל חלד, אלומיניום ונחושת.
- יעיל בתחום pH: 6.5 ל-7.5.
סודיום היפוכלוריט הידוע גם בשם נתרן תת-כלורי (NaOCl) היא תרכובות מבוססת על כלור ונחשבת לאחד החומרים הכי מוכרים לצורכי חיטוי. הוא נוצר בתגובה של גז כלור עם סודה קאוסטית. לשימוש ביתי משתמשים בתמיסות מהולות של 3-6% (אקונומיקה). לחיטוי מים ולטיפול בשפכים משווקות בישראל תמיסות של 12%-10%. במים היפוכלוריט הופך לחומצה היפוכלוריט וסודה קאוסטית . חומצה היפוכלוריט היא הגורם האחראי ליעילות החיטוי של סודיום היפוכלוריט. היא פועלת על ידי חמצון של חלבונים, DNA ו-RNA של חיידקים, וירוסים ופטריות. חומרים אלו הם חיוניים לתפקודם של האורגניזמים הללו, והחמצון שלהם גורם למותם.
תמיסות של נתרן היפוכלוריט מכילות עודף סודה קאוסטית המוכנס כמייצב, המגבירות את הבסיסיות ומעלות את ה-pH. דבר שיכול לתרום קבלה של משקעי אבנית.
את ריכוז הכלור הפעיל בתמיסת היפוכלוריט מבטאים או באחוזים או בגרם לליטר . ריכוז הכלור הפעיל באחוזים משקלי הוא יחס בין כמות הכלור הפעיל במשקל המים למשקל הכולל של התמיסה. במילים אחרות:
ריכוז של כלור בתמיסת סודיום היפוכלוריט מחושב על ידי חלוקת כמות הכלור בתמיסה במשקל המים בתמיסה, ובהכפלת התוצאה ב-100%.
דוגמא לחישוב: אם נמצא שריכוז הכלור הפעיל בתמיסה הוא 120 גרם לליטר
והמשקל סגולי של התמיסה הוא: 1.1654 ק"ג/ ליטר.
משקל הכולל של התמיסה – 1000 גרם * 1.1654 גרם/לליטר = 1165.4 גרם/ליטר
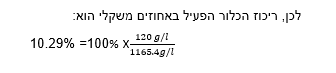
טבלת עזר למשתמש:
| ריכוז כלור פעיל(גרם /ליטר) | משקל סגולי משוער(גרם /ליטר) | ריכוז הכלור הפעיל(% משקלי W/W) |
| 105 | 1.1459 | 9.16 |
| 110 | 1.1524 | 9.54 |
| 120 | 1.1654 | 10.3 |
| 130 | 1.1784 | 11.0 |
לתמיסת היפוכלוריט אין זמן חיי מדף ארוכים היא מתפרקת בהשפעת הטמפרטורה, חשיפה לאור שמש, חשיפה לחמצן, נוכחות מתכות כמו ברזל נחושת וניקל. מצ"ב טבלת זמן חיי המדף לתמיסת היפוכלוריט לפי ת"י 261:
כלור די אוקסיד - דו תחמוצת כלור, ClO2, היא נגזרת נוספת של כלור. בתנאי החדר החומר הוא גז צהבהב. גז לא יציב זה, שעלול להתפוצץ, חייב להיווצר בנקודת היישום. השיטה הנפוצה ביותר לייצור ClO2 היא באמצעות תגובה של גז כלור עם תמיסה של נתרן כלוריט. כלור דו חמצני הוא חומר מחמצן רב עוצמה. הוא מגיב במהירות עם חומרים הניתנים לחמצון, אך בניגוד לכלור, אינו מגיב עם אמוניה. כלור דו חמצני אינו יוצר Trihalomethanes (THM) החשודות כחומר מסרטן.
2NaClO2 + Cl2 → 2ClO2 + 2NaCl
מלח כלור די כלור סודיום כלורט בישול אוקסיד
כלור די אוקסיד מאוד נדיף בהשוואה לחומצה היפוכלוריט (HOCl) הנוצרת בתגובה של כלור או סודיום היפוכלוריט במים ולכן מחייב הקפדה בעת השימוש בו. כלור די אוקסיד הוא גז רעיל יותר מגז הכלור.
כלור דו-חמצני יעיל יותר מהשימוש בגז כלור כאשר ה pH של המים גבוה מ-7. בנוסף כלור דו-חמצני קורוזיבי פחות מכלור ואינו משפיע על חומציות המים. כלור דיאוקסיד יעיל בטווח pH רחב (4-10). כלור דו חמצני יעיל בקטילת פתוגניים העמידים לכלור Giardia ו- Cryptosporidium. כלור דו חמצני מסיר ומונע ביופילם.
קלציום היפוכלוריט המוכר גם בשם סידן תת כלוריטי או ®HTH – הוא חומר כימי בעל הנוסחה הכימית Ca(ClO)2. נוצר בתגובה של כלור עם קלציום הידרוכסיד . זהו כלור מוצק הנמכר כחומר גרגרי או כטבליות .מכיל 65%-70% כלור זמין . מנגנון החיטוי מבוסס על חומצה היפוכלוריט הנוצרת כאשר קלציום היפוכלוריט בא במגע עם מים. כאשר משתמשים בסידן היפוכלוריט ,0.8 ppm של קשיות סידן מתווספת למים עבור כל ppm של כלור זמין שהתווסף. דבר שיכול להביא לקבלת משקעי אבנית על המערכת. תמיסות של קלציום היפוכלוריט מכילות עודף קלציום הידרוכסיד שתורמות לעלית ה-pH. דבר שיכול לתרום גם הוא לקבלה של משקעי אבנית. קלציום היפוכלוריט פחות מסיס במים מאשר סודיום היפוכלוריט ופחות יעיל. סידן היפוכלוריט מאבד 3%-5% מתכולת הכלור שלו בשנה באחסון רגיל.
טרי-כלורו-איזו-ציאנורט TCCA – הנוסחה הכימית שלו: C3Cl3N3O3 .
נמכר כחומר גרגרי או בטבליות בריכוז של 90% כלור פעיל. זהו חומר קשה תמס ואינו מתמוסס במהירות במים . חברתנו דשנים וחמרים כימיים מקבוצת ICL מוכרת את המוצר הזה תחת השם אלגציד בצורה גרגרית. מנגנון החיטוי שלו דומה לתרכובות האחרות .הוא מבוסס על היווצרות חומצה היפוכלוריט.
TCCA + 3 H2O → 3 HOCl + C3N3O3H3
חומר זה מיוצב בעזרת חומצה ציאנורית ולכן הוא יציב יותר ולא מתפרק כפי שסודיום היפוכלוריט וקלציום היפוכלוריט מתפרקים בנוכחות חום ואור. החומצה הציאנורית המופקת בתגובת ההידרוליזה תישאר שלמה במשך זמן מה מכיוון שהיא אינרטית למדי מבחינה כימית. חומצה ציאנורית תתפרק בסופו של דבר. חומצה ציאנורית נמצאת באופן טבעי באדמה ברמות של 1-6 ppm ומתכלה בקלות במגוון רחב של תנאים טבעיים. החומצה מתכלה על ידי מספר זני פטריות, כולל פטריות קרקע. הוא מפורקת על ידי כמה זני חיידקים, כולל חיידקי הקרקע Hormodendrum masonii. מתפרקת טוב במיוחד במערכות עם רמת חמצן מומס נמוכה או אפסית כגון בוצה פעילה אנאירובית וביוב, קרקעות, בוץ ונחלים בוציים ומי נהרות, כמו גם מערכות בוצה פעילה . תוצרי הפירוק הם: CO2 ואמוניה.
די-כלורו-איזו-צינוריק-אסיד – NaDCC החומר זמין בשתי צורות די הידרט (NaC3N3O3Cl2•2H2O) וכנטול מים (NaC3N3O3Cl2). תכולת הכלור הזמינה היא 56% ו-62%, בהתאמה. די כלור נטול מים הוא מחמצן מסוג NFPA Class 3. לדי הידרט יש דירוג סיכון נמוך יותר של NFPA Class 1. חברתנו מוכרת את המוצר בשם ®ChloRun ריכוז החומר הפעיל הוא 56% . NaDCC (נטול מים ו- די הידראט) מיוצר על ידי תגובה ראשונה של כלור עם חומצה ציאנורית בתמיסה אלקלית מימית לייצור חומצה דיכלורואיזוציאנורט מונוהידרט. מונו-הידרט מומר לדי-הידרט של NaDCC. אם מחממים אותו מקבלים את החומר הנטול מים. גם הדי-הידרט וגם הנטול מים מיוצרים כאבקות או חומר גרגרי וגם כטבליות. מנגנון החיטוי בדומה למה שהוזכר עד כה מבוסס על היווצרות של חומצה היפוכלוריט .
ה- ®ChloRun בניגוד ל אלגציד הוא חומר מסיס מאוד במים. הוא יעיל יותר ויציב יותר מסודיום היפוכלוריט וקלציום היפוכלוריט בחשיפה לחום ולאור:
*הערה חשובה: סידן היפוכלוריט (HTH) ואיזו ציאנורטים עם כלור TCCA NaDCCA-I אינם תואמים. ערבוב של כימיקלים אלו עלול ליצור תערובת נפיצה!
כלורואמינים - שיטת חיטוי זאת מוכרת משנות ה – 30 של המאה הקודמת. השיטה מבוססת על תגובה בין כלור (Cl2) ואמוניה (NH3). כלורואמינים הם אמינים המכילים לפחות אטום כלור אחד, אשר קשור ישירות לאטומי חנקן (N). כלורואמינים אנאורגניים נוצרים כאשר כלור מומס ואמוניה מגיבים. במהלך תגובה זו נוצרים שלושה כלורואמינים אנאורגניים שונים; מונוכלוראמין (NH2Cl), דיכלורואמין (NHCl2) וטריכלוראמין (NCl3).
כלורואמינים מיוצרים על ידי הוספת אמוניה למים המכילים כלור חופשי (HOCl או OCl, בהתאם ל-pH). ערך ה-pH האידיאלי לתגובה זו הוא 8.4. זה אומר שהמים יהיו מעט בסיסיים.
NH3 (aq) + HOCI -> NH2Cl + H2O
כאשר התגובה מתרחשת יכולים להיווצר שלושה סוגים של כלורואמינים אנאורגניים. ערך ה-pH קובע איזה סוג של כלורואמין נוצר. טריכלוראמינים נוצרים בעיקר כאשר ערך ה-pH הוא 3 ומטה. כאשר ערך ה-pH הוא 7 ומעלה, ריכוזי מונוכלוראמין הם הגבוהים ביותר.
מקור : http://www.epa.gov/ogwdw/mdbp/pdf/alter/chapt_6.pdf
מונוכלוראמין הוא קוטל חיידקים פחות יעיל מכלור, אך מייצר הרבה פחות תוצרי לוואי רעילים. חומרי הלוואי שלו עלולים להשפיע על הטעם והריח של המים.
| אפקט חיטוישל הביוציד | pH | משקלמולקולרי | שם | נוסחה |
| טוב | 7< | 52 | monochloramine | NH2Cl |
| סביר | 4-7 | 85 | dichloramine | NHCl2 |
| סביר | 1-3 | 119 | trichloramine | NCl3 |
סיכום: כלור ונגזרותיו מאוד חשובים לצורך חיטוי במיוחד של מי השתייה. לכל אחד מחומרי החיטוי מבוססי כלור שהוזכר במאמר זה יש יתרונות אך גם חסרונות. כל חומרי החיטוי יוצרים תרכובות-לוואי שונות, במגע עם מים מכילי חומר אורגני. לכל סוג של תרכובות-לוואי יש השפעה אחרת על הבריאות. חשוב לסלק את החומר האורגני מהמים כדי להקטין את קבלת חומרי הלוואי.
לפי תקנות מי השתייה בישראל ריכוז הכלור הפעיל במים לצרכנים הוא 0.1-0.5 ppm.
מבחינה בטיחותית יש לשים לב שמגע של ®ChloRun, סודיום היפוכלוריט, קלציום היפוכלוריט עם חומצה כל שהיא, עלולה לגרום לפליטת כלור במהלך תגובה ביניהם.
תגובה בין חומרים אלה לחומרים אורגניים עלולה לגרום להתלקחות החומרים האורגניים בכללותם.
להלן טבלה מסכמת לריכוז הכלור הפעיל:
| השם הכימי | כלור פעיל זמין % |
| chlorine (Cl2) | 100 |
| calcium hypochlorite (Ca(OCl)2) | 70-74 |
| sodium hypochlorite (NaOCl) | 12-10 |
| household bleach | 3-5 |
| TCCA | 90 |
| NaDCC | 56-62 |